Eduardo Geraque, Pesquisa Fapesp
Testes das vacinas em estágio avançado contra a doença prosseguem em ritmo acelerado, apesar de interrupções pontuais por razões de segurança
Karolina Grabowska / Pexels
Interrupções nos chamados testes clínicos, feitos em seres humanos, de vacinas e remédios são vistas como percalços inerentes ao processo de desenvolvimento de novos produtos. Quando ocorre algum efeito colateral grave que pode estar associado ao uso do imunizante ou da droga, ou a morte inesperada de um participante dos experimentos, os promotores dos testes têm de avaliar se é seguro prosseguir com os trabalhos. Às vezes, as autoridades sanitárias obrigam os desenvolvedores a parar com os testes até que fiquem demonstradas a causa da intercorrência e a segurança do produto. Caso as explicações mostrem não haver relação clara com o fármaco testado, os trabalhos podem ser retomados. Do contrário, os testes podem ser abandonados.
O público raramente fica sabendo desses percalços. Mas, entre setembro e outubro, os testes clínicos de fase 3, a última etapa antes da aprovação final, de duas vacinas contra Covid-19 — a da empresa britânica AstraZeneca em parceria com a Universidade de Oxford e a da farmacêutica Janssen, do grupo norte-americano Johnson & Johnson — sofreram interrupções que se tornaram notícia. Em ambos os casos, os trabalhos foram retomados, mas a divulgação da parada temporária nas pesquisas gerou preocupação. As duas vacinas usam diferentes adenovírus (vírus que causam problemas respiratórios em animais ou humanos) para transportar material do Sars-CoV-2 capaz, em teoria, de estimular uma resposta imunológica em seus recebedores.
Na fase 3 dos testes, enquanto um grupo de voluntários recebe a droga que está sendo testada, outra parcela é medicada com placebo, um composto inócuo. Para garantir a idoneidade do processo, os promotores dos ensaios não sabem de que grupo fazem parte os participantes dos trabalhos. As reações adversas consideradas médias, como leves dores de cabeça e no local de aplicação da vacina, não são suficientes para paralisar um protocolo. Quando os desdobramentos são mais graves, como o surgimento de inflamações no sistema nervoso ou até risco de morte, a situação muda e um comitê independente é chamado para analisar o caso. “Em testes clínicos grandes sempre há intercorrências. Isso é normal e o comitê de especialistas avalia a situação”, pondera o imunologista Jorge Kalil, da Faculdade de Medicina da Universidade de São Paulo (FM-USP) e diretor do Laboratório de Imunologia do Instituto do Coração (InCor). “Os problemas podem não estar diretamente relacionados com a vacina. Quando isso fica comprovado, o estudo segue. A esperança nas vacinas contra Covid-19 continua alta.”
O primeiro contratempo veio a público há cerca de dois meses. Um comunicado da AstraZeneca, que testa sua candidata a vacina em 50 mil indivíduos do Reino Unido, Brasil, Índia, África do Sul e Estados Unidos, foi divulgado no dia 8 de setembro confirmando uma notícia publicada dois dias antes pela imprensa: os trabalhos tinham sido suspensos porque um participante britânico do estudo apresentou reações adversas. Ele adoeceu sem explicação e desenvolveu mielite transversa, uma inflamação que atinge a medula espinhal. O imunizante tinha passado sem maiores percalços pelas fases 1 e 2 dos testes clínicos. “A vacina de Oxford foi dada para um grande número de pessoas. Por isso, ocorrer esse tipo de situação, não obrigatoriamente causada pelo produto em teste, é bastante plausível”, afirma o virologista Celso Granato, da Universidade Federal de São Paulo (Unifesp) e diretor clínico do Grupo Fleury.
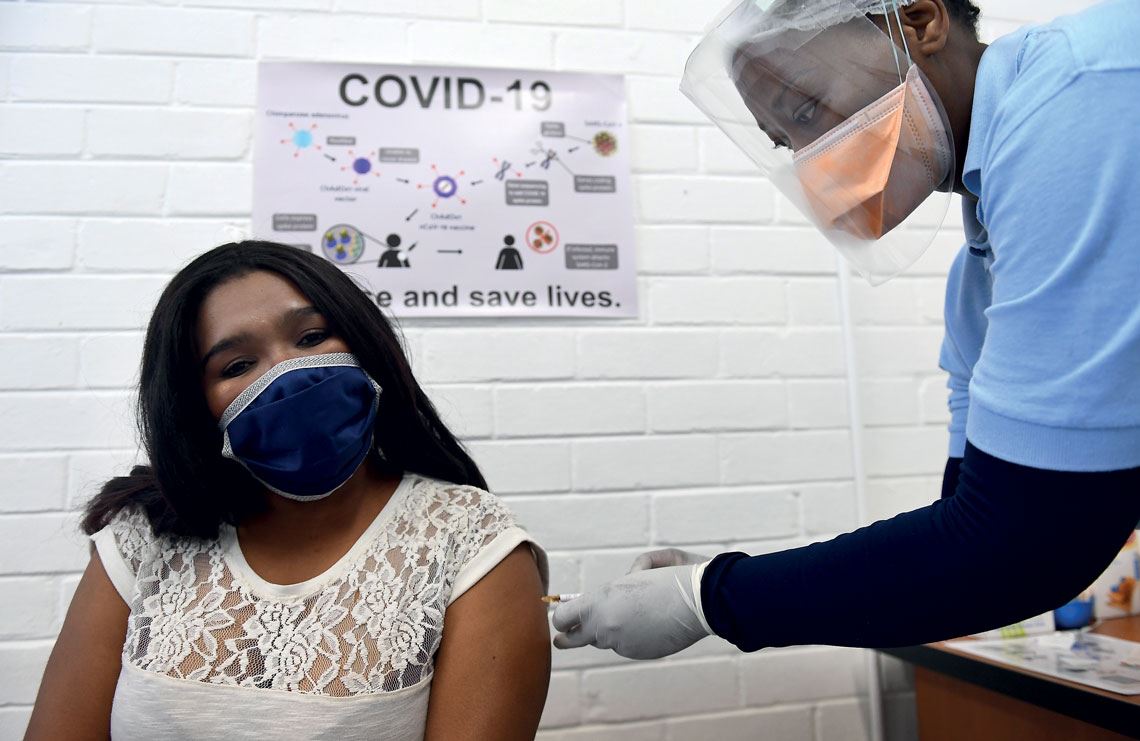
Aplicação da vacina da AstraZeneca durante teste clínico em andamento na África do Sul (foto: Felix Dlangamandla / Beeld /Gallo Images via Getty Images)
As explicações fornecidas pela AstraZeneca, dissociando o problema de saúde do emprego da vacina, foram consideradas satisfatórias, com os testes sendo retomados nos países, alguns de forma mais rápida e outros mais lentamente. No Brasil, uma semana após a notificação do incidente, os trabalhos com o imunizante foram reiniciados. Nos Estados Unidos, o aval ocorreu apenas no dia 23 de outubro. Em outro episódio, o jornal O Globo divulgou no dia 21 de outubro a morte de um voluntário que participou dos testes da vacina britânica no Brasil. Mas, segundo o diário, essa pessoa fazia parte do grupo de controle, que recebeu placebo e não o imunizante. O caso não provocou a suspensão dos testes.
O segundo candidato a imunizante em fase 3 que teve seus ensaios clínicos temporariamente suspensos foi o da subsidiária do grupo Johnson & Johnson. A parada ocorreu nos Estados Unidos oficialmente no dia 12 de outubro. O motivo da paralisação foi parecido com o que afetou os testes da vacina da AstraZeneca: um voluntário teria tido um derrame, cuja causa teve de ser investigada. Não foi divulgado se o indivíduo que apresentou a intercorrência era do grupo de controle ou tinha recebido o imunizante. No dia 23 de outubro, foi noticiado pelo jornal norte-americano Washington Post que a empresa teria recebido o sinal verde da FDA, autoridade sanitária norte-americana, para retomar os testes.
Além das duas vacinas, testes conduzidos pelos Institutos Nacionais de Saúde (NIH) com um tratamento experimental contra Covid-19 foram igualmente suspensos em razão de possíveis efeitos adversos. Foi o que ocorreu com o emprego do anticorpo monoclonal desenvolvido pelo laboratório norte-americano Eli Lilly, medicamento feito a partir de glóbulos brancos de um dos primeiros pacientes recuperados da infecção por Sars-CoV-2 nos Estados Unidos. A interrupção da terapia, similar a uma das que teriam sido administradas ao presidente Donald Trump durante sua internação por causa do novo coronavírus, foi anunciada em 13 de outubro sem muitas explicações.
De acordo com a empresa, houve uma discrepância importante na condição clínica dos participantes que receberam o placebo em comparação com a dos medicados com o anticorpo monoclonal, que também receberam outra droga experimental, o remdesivir. A situação levou à suspensão da pesquisa para uma reavaliação dos protocolos. Embora a Eli Lilly esteja pleiteando a aprovação em caráter emergencial de seu tratamento, os testes patrocinados pelos NIH ainda não foram reiniciados.

Técnicos trabalham no laboratório da Janssen na Bélgica, que faz uma das candidatas a vacina de Covid-19 que sofreu breve interrupção em seus testes (foto: Olivier Matthys / Getty Images)
Devido à gravidade da pandemia, os testes com vacinas e medicamentos estão sendo conduzidos a uma velocidade sem precedentes e com grande cobertura dos meios de comunicação. “A excitação e a ansiedade confundem muito o público leigo”, afirma Paulo Lotufo, diretor do Centro de Pesquisa Clínica e Epidemiológica da USP. “Normalmente, poucas pessoas acompanham testes clínicos porque eles envolvem doenças específicas”, diz Lotufo.
Como as vacinas têm como público-alvo pessoas saudáveis, os cuidados são redobrados. Segundo Lotufo, um exemplo hipotético reforça a importância de testes com imunizantes serem feitos com rigor. “Imagine um medicamento para câncer de pulmão com resultados muito bons. Ele aumenta em dois anos a sobrevida dos pacientes, mas também eleva a incidência de diabetes em 50% dos casos. Nesse contexto, o novo problema de saúde não tem muita importância. Alguns pacientes de câncer já são diabéticos e essa é uma doença que sabemos controlar”, pondera o epidemiologista. “Mas a situação muda se estamos diante de uma vacina que, apesar de muito eficaz, aumenta o risco de diabetes em pessoas saudáveis, algo ruim.”
O fato de o fracasso ser mais comum do que o sucesso nos testes de vacinas é embasado por números. Um estudo publicado em maio no repositório do National Bureau of Economic Research (NBER), a partir de trabalho de pesquisadores do Massachusetts Institute of Technology (MIT), mostra que a taxa de aprovação de novas vacinas nos Estados Unidos entre janeiro de 2000 e janeiro de 2020 foi de 39,6%. Os pesquisadores analisaram 1.838 testes clínicos patrocinados pela indústria desde a fase 1 e registraram que a maioria ficou pelo caminho.
Outro relatório publicado em 2017 pela FDA mostra como a chegada à reta final do processo de desenvolvimento de uma droga não significa sua aprovação. O estudo avaliou 22 casos que fracassaram nos últimos anos. Desse total, cinco eram vacinas – todas foram reprovadas de forma definitiva na fase 3, principalmente por falta de eficácia.
Os projetos farmacêuticos que naufragaram buscavam vacinas específicas: contra herpes genital; para manter a produção de insulina em pacientes com diabetes tipo 1; para tratar pacientes recém-operados de um tipo de câncer de pulmão; contra tabagismo; e para prevenir a infecção por Staphylococcus aureus, bactéria que pode causar pneumonia ou infecção cardíaca.
No caso do coronavírus, como as vacinas têm como público-alvo boa parte da população global, o número de pessoas usadas na fase 3 precisa ser ainda maior. Por isso, o risco de surgirem problemas também aumenta. Mas, em compensação, o número elevado de imunizantes em fase de testagem avançada amplia as chances de algumas delas darem certo. Das 44 vacinas em desenvolvimento contra o coronavírus que estão sendo testadas em humanos, 10 estão na derradeira fase 3. “É preciso que se façam esforços para uma vacina segura e eficaz, mas no menor tempo que os procedimentos de segurança permitirem”, afirma Granato.