Versamune e ButanVac entraram com pedido na semana passada para realização de testes em humanos, para serem produzidas no Brasil

Foto: v-3-5-N-a / Pixabay
No final da semana passada, duas potenciais novas vacinas contra a covid-19 entraram com pedido na Anvisa para realização de testes clínicos: a Versamune, que está sendo desenvolvida pela Faculdade de Medicina de Ribeirão Preto da USP, em parceria com a startup Farmacore e a estadunidense PDS Biotechnology, e a ButanVac, pelo Instituto Butantan em parceria com o Icahn School of Medicine, no Mount Sinai, em Nova York (EUA).
Versamune
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu o pedido para início da fase de ensaio clínico nas fases 1 e 2 da vacina Versamune na última quinta-feira, 25 de março. O imunizante contra covid-19 é uma produção do consórcio formado pela Faculdade de Medicina de Ribeirão Preto (FMRP) da USP, com a Farmacore, startup brasileira responsável pelo desenvolvimento tecnológico, e a PDS Biotechnology, que licenciou para a Farmacore o sistema adjuvante/carreador da formulação vacinal.
O trabalho está sendo coordenado pelo professor Celio Lopes Silva do Departamento de Bioquímica e Imunologia da FMRP e conta com apoio e financiamento do Ministério da Ciência, Tecnologia e Inovações (MCTI). Na primeira fase do ensaio clínico, o imunizante será aplicado em 360 voluntários, e os pesquisadores estimam concluir as fases 1 e 2 entre três ou quatro meses com início em maio. Já a fase 3 deverá contar com 20 mil voluntários em diversos estados do Brasil.
A previsão é que todo o estudo clínico seja finalizado entre nove e 12 meses, ou seja, caso tudo dê certo, a vacina desenvolvida na USP em Ribeirão Preto pode estar disponível para a população no início de 2022. No sábado, dia 27 de março, a Anvisa solicitou os resultados do controle de qualidade dos insumos e do ensaio pré-clínico, que estão em fase de finalização pelo consórcio.
“Os resultados dos estudos não clínicos mostraram que ela é segura para animais e, diferentemente das outras vacinas, ela tem a capacidade de ativar todo o sistema imunológico que impede não só a entrada do sars-cov-2 para dentro das células como também matam as células já infectadas. Acreditamos que o imunizante gere uma memória imunológica de até 12 anos”, afirma o professor Célio Lopes Silva.
Além disso, conta o professor, essa vacina induz a memória imunológica de longa duração; é simples e segura (não contém vírus inativados, partículas virais, adjuvantes tradicionais e complexos, DNA, mRNA); tem boa estabilidade e facilidade nas estratégias de produção e distribuição; conta com facilidades tecnológicas para que possa ser produzida integralmente no Brasil nas fases de vacinação em massa; e permite estabelecer uma base tecnológica nacional para ajudar a vencer futuros desafios de novas pandemias que possam impactar significativamente a saúde da população.
Os pesquisadores produziram uma formulação vacinal composta do antígeno S1 do sars-cov-2, obtido na forma recombinante, e associado a uma nanopartícula lipídica denominada Versamune que é usada como carreador/adjuvante vacinal. Essa formulação composta da S1 e Versamune, induz ativação da imunidade humoral (ativação de linfócitos B para produção de níveis elevados de anticorpos neutralizantes que impedem a entrada do vírus para dentro das células), imunidade celular (ativação de linfócitos T CD8 e T CD4 que eliminam as células infectadas) e imunidade inata (ativação da via de sinalização de IFN tipo I, que é crítica para manter o sistema imunológico ativado e a geração de respostas imunes adaptativas sustentadas contra infecções virais). Além disso, a Versamune participa da ativação de células NK, macrófagos e células dendríticas que são importantes para ativação geral do sistema imune e combater infecções virais.
“No geral, podemos definir essa como uma vacina nanoparticulada, que contém o antígeno S1, veiculada com um carreador. É um imunizante que, ao entrar na célula, estimula todo o sistema imunológicoo”, resume Silva ao Jornal da USP.
O investimento reúne recursos do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), da Farmacore Biotecnologia Ltda. e da americana PDS Biotechnology.
ButanVac
Na última sexta (26) Instituto Butantan anunciou que pediria à Agência Nacional de Vigilância Sanitária (Anvisa) autorização para iniciar em abril um ensaio clínico de fases 1 e 2 para o desenvolvimento da ButanVac, mais uma vacina contra a covid-19 que pode se juntar ao plantel dos imunizantes produzidos no Brasil. Uma produção em pequena escala já foi finalizada para ser aplicada nos voluntários dos testes.
Os resultados das fases 1 e 2 visam a determinar se a vacina é segura e tem resposta imune capaz de prevenir o desenvolvimento da doença. Em caso positivo, o estudo pode prosseguir para a fase 3, em que uma quantidade maior de voluntários (milhares) é vacinada e acompanhada.
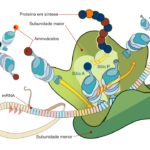
A ButanVac é diferente da CoronaVac, a vacina produzida pelo Butantan que está sendo aplicada atualmente na população brasileira. Enquanto que a CoronaVac utiliza uma versão inativada do próprio sars-cov-2 inteiro, a ButanVac tem como “princípio ativo” um vírus geneticamente modificado em laboratório para expressar em sua superfície uma única proteína do novo coronavírus – a proteína spike (S), que o sars-cov-2 utiliza para entrar nas células humanas e tem sido a mais utilizada em projetos de vacinas para gerar uma resposta imune específica contra ele. O vírus modificado é o da doença de Newcastle (NDV, em inglês), um patógeno que causa gripe em aves mas é inofensivo aos seres humanos.
Espera-se que a pessoa que receber a vacina gere uma resposta imunológica contra a proteína S. Assim, se ela entrar em contato posteriormente com o sars-cov-2, seu organismo já terá aprendido a combater o vírus da covid.
Figurativamente falando, é como se você colocasse uma máscara com o retrato-falado de um bandido sobre o rosto de uma pessoa inocente (o vírus geneticamente modificado) e soltasse essa pessoa no transporte público de uma cidade (o organismo da pessoa vacinada), para treinar a polícia local (o sistema imunológico) a reconhecer o rosto do fugitivo no meio da multidão e prendê-lo antes que ele tenha tempo de praticar algum crime (causar a covid-19).
A capacidade de gerar resposta imune da vacina é promissora, na perspectiva de Olga Chaim, professora licenciada da UFPR e atualmente pesquisadora na Universidade da Califórnia em San Diego, em razão escolha do vírus Newcastle, que foi “isolado de aves e já se mostrou bastante imunogênico em testes in vitro e nos testes pré-clínicos em animais. É um perfeito candidato. Não gera doença, mas ativa resposta imune”.
No processo de fabricação da vacina, o vírus modificado é injetado em ovos de galinha com os embriões ainda vivos. Uma agulha fura o topo do ovo e outra insere o vírus. Após um intervalo, o vírus se replica dentro do ovo, que é colocado numa câmara fria. O embrião morre e os vírus são liberados para o líquido que fica ao redor do embrião. Depois o líquido é purificado, e o vírus é inativado (para impedir que se replique e cause doença). Finalmente, o líquido é adicionado à formulação da vacina, processado e envasado.
É exatamente o mesmo processo utilizado pelo Butantan para a produção da vacina sazonal da gripe; e é aí que reside o grande trunfo do instituto para desenvolver e produzir essa nova vacina aqui também. Já a CoronaVac não pode ser produzida dessa forma porque o sars-cov-2 não se reproduz em ovos de galinha e precisa ser multiplicado em culturas de células in vitro.
O vírus Newcastle modificado (NDV-S) foi desenvolvido por cientistas da Icahn School of Medicine, no Mount Sinai, em Nova York (EUA). Já a proteína S estabilizada do vírus sars-cov-2 utilizada na vacina foi desenvolvida na Universidade do Texas em Austin. Os testes pré-clínicos, com animais, foram feitos nos Estados Unidos, e a ideia é que os testes clínicos (com seres humanos) ocorram no Brasil, Vietnã e Tailândia.
“A iniciativa faz parte de um consórcio internacional em que o Butantan é o principal produtor, com 85% da capacidade total de produção, e tem o compromisso de fornecer a vacina ao Brasil e a países de baixa e média renda”, informou o instituto, em seu primeiro comunicado, do dia 26 de março.
O Butantan é um dos responsáveis por desenvolver clinicamente o produto, escalonar e padronizar os processos produtivos e produzir a vacina. De acordo com o instituto, todos os processos produtivos, desde a qualificação dos ovos embrionados, inoculação, crescimento viral, processamento e purificação viral, inativação, formulação, qualificação, controle de qualidade, produção em escala, envase, rotulagem e registro sanitário serão realizados em suas instalações.
Segundo Ricardo Palacios, diretor médico de pesquisa clínica do instituto, a nova vacina terá perfil alto de segurança. “Nós sabemos produzir a ButanVac, temos tecnologia para isso e sabemos que vacinas inativadas são eficazes contra a covid-19. Poder entregar mais vacinas é o que precisamos em um momento tão crítico”, explica, em nota publicada pelo Butantan.
“Por isso é tão importante termos nossa própria expertise e fábricas rodando no Brasil”, disse ao Jornal da USP o biólogo Paulo Lee Ho, pesquisador e ex-diretor do Centro de Biotecnologia e da Divisão de Desenvolvimento Tecnológico e Produção do Instituto Butantan. Apesar do vírus modificado ter sido desenvolvido nos Estados Unidos, ele destaca que todo o processo de produção e transformação desse vírus em uma vacina propriamente dita será desenvolvido dentro do Butantan. “Inovação não é uma ideia; inovação é produto”, diz. “E se você não desenvolve produção, você não tem produto.”
É uma situação diferente da CoronaVac, em que o insumo farmacêutico ativo (IFA) contendo o vírus inativado é produzido pela empresa Sinovac, na China, e enviado já pronto ao Brasil para ser processado e envasado no Butantan. No caso da ButanVac, o IFA será produzido aqui desde o início, utilizando a plataforma de cultivo viral em ovos do Instituto.
Dimas Covas, diretor do Instituto Butantan, afirma que será possível entregar a ButanVac à população ainda neste ano – dependendo, é claro, do sucesso dos testes clínicos e aprovação dos resultados pela Anvisa. “Após o final da campanha de produção da Influenza, que termina em maio, podemos iniciar imediatamente a produção da ButanVac. Atualmente, nossa fábrica envasa a Influenza e a CoronaVac”, diz.