Tatá explica por quê o gelo flutua
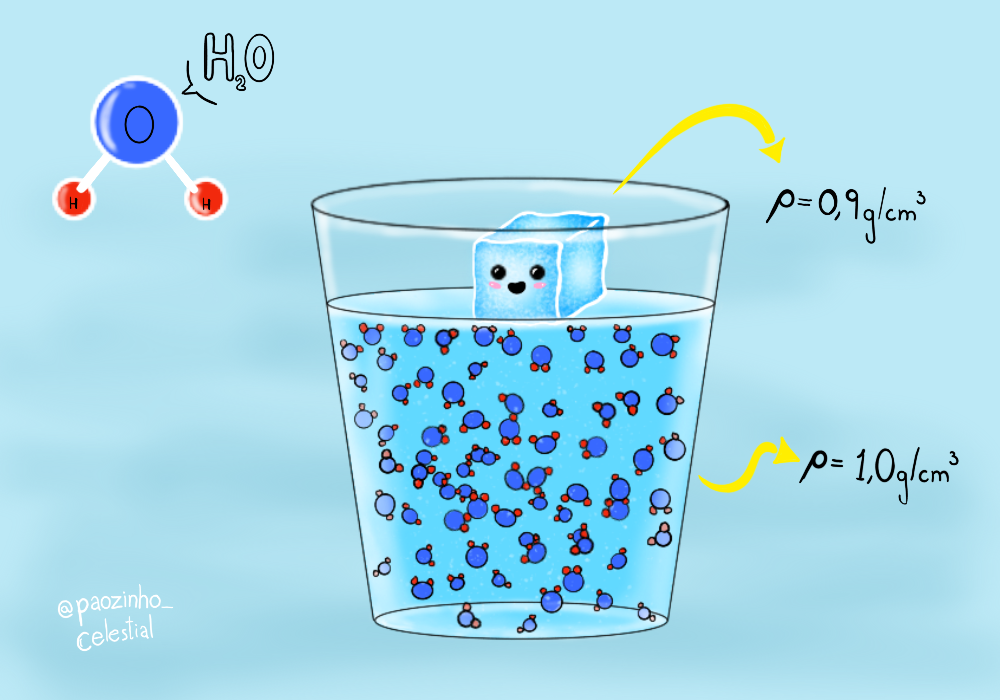
ilustração: @paozinho_celestial
Algumas coisas já estão tão inseridas em nossas vidas que nem nos perguntamos muito sobre o motivo de serem assim. Com o aquecimento global, estamos vendo que as geleiras estão derretendo. Mas o fato de o gelo ficar na superfície da água e não afundar, te parece óbvio?
Em Física 2, estudamos muitas coisas, a principal é termodinâmica. Claro que não é com tanto afinco como na disciplina Termodinâmica, mas de forma geral, dá para o gasto.
Vamos lá: se gelo é água em estado físico sólido, por que ele flutua no meio líquido? Estou me sentindo no antigo programa do Silvio Santos em que ele só dava as pistas que estavam na carta, e o povo tinha que adivinhar do que ele estava falando.
Para fins didáticos, pegue um copo e encha com água, depois coloque um cubo de gelo. Eu sei que você sabe qual é o resultado, mas, se trocarmos o gelo por uma pedra, o que aconteceria? A pedra afundaria, né? Então por que o gelo flutua, e a pedra, não? O gelo flutua a despeito de seu volume, mas depende do volume da água. Mesmo que a maior parte esteja submersa na água, ainda não é um afundamento. Esse fenômeno está ligado diretamente à densidade dos objetos de estudo do nosso experimento. A densidade é uma relação entre massa e volume, a pedra é mais densa que água, por isso afunda. Já o gelo, é menos denso. Mas, se o gelo nada mais é do que água congelada, por que temos essa diferença? Talvez o mais intuitivo fosse pensar que o gelo é mais pesado do que a água. A densidade da água é de 1,0 g/cm3 e do gelo é de 0,92 g/cm3 e por isso, 92% do gelo fica submerso na água e os outros 8% acima da superfície.
A maioria das substâncias é mais densa em seu estado sólido, o gelo é uma exceção, o que ocorre principalmente pela estrutura molecular do gelo. No estado líquido da água, temos moléculas formadas por dois átomos de hidrogênio e um de oxigênio (H2O). As ligações de hidrogênio são ligações entre as moléculas da água e funcionam de tal forma que a carga positiva dos átomos de hidrogênio é atraída pela carga negativa dos átomos de oxigênio das outras moléculas, formando a ligação. Já no estado sólido da água, essas ligações organizam as moléculas em uma estrutura cristalina, em que as moléculas ficam mais afastadas umas das outras do que no estado líquido. Essa outra organização no estado sólido faz com que a densidade do gelo em relação à água líquida seja reduzida, resultando na flutuação.
Pensar em icebergs e na flutuação deles já é um tanto abstrato, porque sabemos que são imensos. Mas, em comparação com o oceano, são bem pequenos. E flutuam tal qual uma pedra de gelo num copo. Proporções à parte, estamos falando de gelo e água, e a mesma regra se aplica.
Agora que o nosso experimento acabou, tome a sua água geladinha, e eu te aguardo aqui, para discutirmos mais assuntos interessantes (ou talvez não) do mundo da física.