Artigo de cientistas brasileiros publicado hoje na Scientific Reports destaca o papel de um gene e da disposição espacial de células na emergência do problema
Imagem: Raman Oza / Pixabay
Michael Ojo, 27 anos, nigeriano, pivô conhecido do basquete nos Estados Unidos depois de jogar quatro temporadas na liga universitária pelo Florida State Seminoles, morreu de ataque cardíaco em 7 de agosto passado, enquanto praticava arremessos sozinho na quadra de seu novo time, o Estrela Vermelha, da Sérvia. Ojo contraíra covid-19 no final de junho, segundo Nebojsa Covic, presidente do clube. Ele é personagem, assim, de um caso entre outros relatados de atletas jovens em que a miocardite provocada pela covid, embora aparentemente a doença estivesse superada, levou à morte. Por quê?

Michael Ojo, atuando pelo Estrela Vermelha em outubro de 2019 (foto: Sakhalinio – CC BY-SA 4.0)
Há uma questão bastante desafiadora na cardiologia que é o fato de a cicatrização do músculo cardíaco criar, por si mesma, novos sítios ou focos de arritmia potencialmente perigosos para o paciente, após alguma lesão, seja ela provocada por infarto, covid-19 ou outros eventos infecciosos. Os esforços atuais para compreender e detalhar esse processo lembra a busca e a reunião, pouco a pouco, de inumeráveis pecinhas espalhadas de um grande e complicado quebra-cabeça. E isso é assim desde que cientistas constataram desolados, na primeira década de 2000, que as células-tronco adultas, capazes de tantas admiráveis proezas de metamorfoseamento em outras células, não seriam uma alternativa para esse problema do coração. Simplesmente porque não conseguem se transformar nas altamente especializadas células do músculo cardíaco.
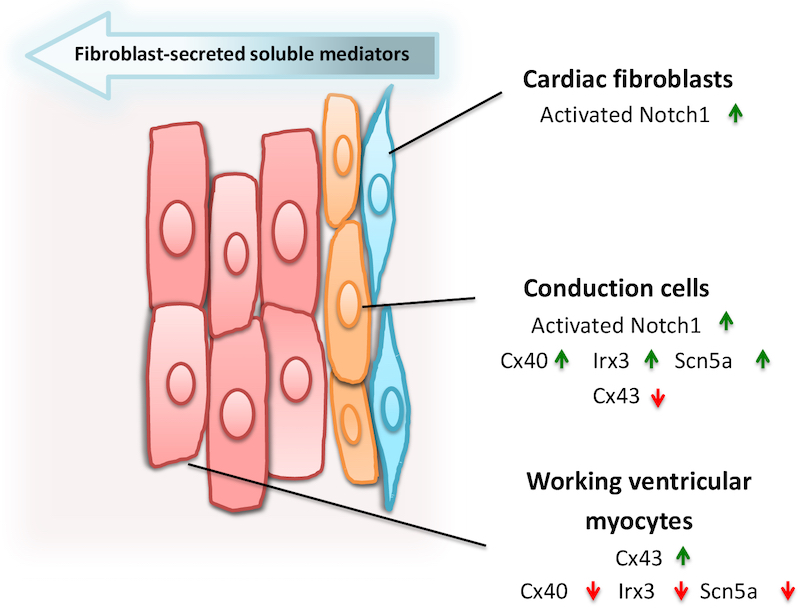
Agora, uma nova peça se junta ao quebra-cabeça, com o artigo publicado por um grupo de pesquisadores brasileiros nesta quarta-feira, 30 de setembro, na Scientific Reports. O título, “Notch1 is critical for fibroblast-mediated induction of cardiomyocyte specialization into ventricular conduction system-like cells in vitro” (em tradução livre, “O gene Notch1 é fundamental para induzir a especialização de cardiomiócitos no sistema de condução ventricular em células in vitro, mediada por fibroblastos”), certamente entrega boa parte do conteúdo para os pesquisadores da área. Mas parece mistério puro para os curiosos de outras áreas e amadores da ciência interessados nas desventuras do coração.
Vale, portanto, tentar contar isso com outras palavras. O principal recado que esse título contém é que os autores do artigo, trabalhando com células in vitro, isto é, cultivadas em placas e não diretamente manipulando cobaias vivas, identificaram o gene chamado Notch1 como um responsável fundamental, o que não quer dizer único, no processo de formação de células do músculo cardíaco no sistema de condução ventricular.
Nos termos de um trecho da conclusão do artigo, tem-se “evidências de que os fatores secretados por fibroblastos cardíacos ativam a sinalização de Notch1 para induzir a maturação pós-natal de cardiomiócitos”.
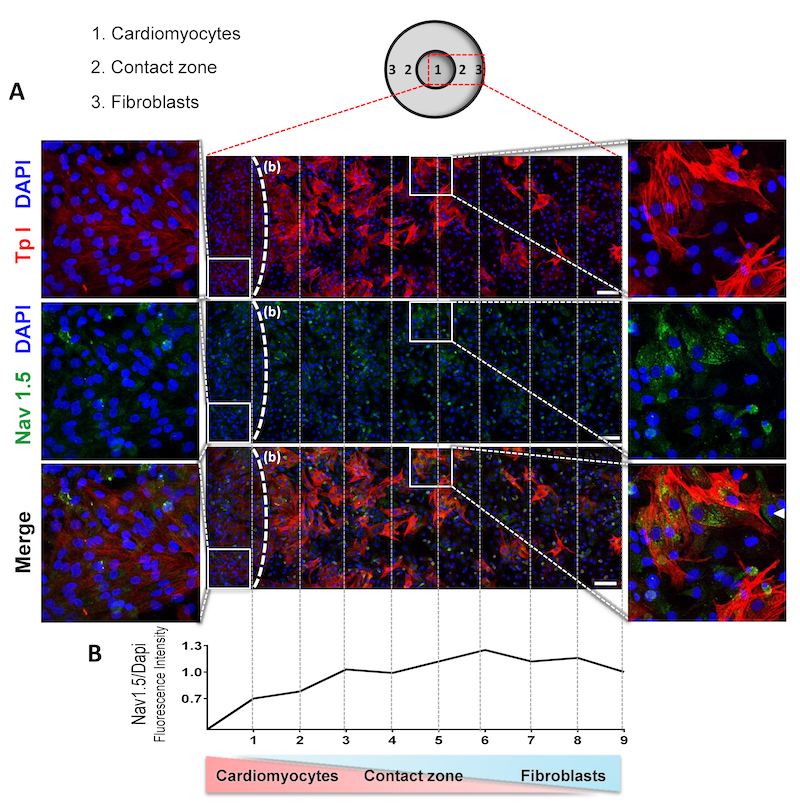
Figura A: Núcleos celulares (DAPI), cardiomiócitos (em vermelho), fibroblastos cardíacos e Nav1.5 (em verde). A linha pontilhada (b) delimita a área enriquecida com cardiomiócitos à esquerda do início da zona de contato. Amostras dessa área e da zona de contato estão ampliadas respectivamente à esquerda e à direita da figura. Figura B: intensidade da fluorescência de Nav1.5/Dapi. (crédito: https://doi.org/10.1038/s41598-020-73159-0)
Na sequência, é dito que a própria secreção dos fatores em causa pelos fibroblastos também é ativada pelo gene Notch1. E fibroblastos, vale lembrar, são células do tecido conjuntivo, aquele que está na matriz extracelular, secretam proteínas essenciais como o colágeno e a elastina e têm papel central na regeneração.
Os cardiomiócitos são de dois tipos: os de trabalho e os condutores, especializados na condução do sinal elétrico no músculo, vital a seu funcionamento, e há vários genes na origem de uns e outros.
E um aspecto muito importante a lembrar sobre eles, ensina o professor José Eduardo Krieger, titular da Faculdade de Medicina da Universidade de São Paulo (FMUSP), último autor do artigo, por ser o pesquisador sênior do estudo que o sustenta, é que sua produção é absolutamente irrisória após o nascimento. Em humanos, “apenas dois ou três dias após o nascimento, a produção cai drasticamente e só cresce a taxas de 1% a 2% ao ano, ao longo de décadas da vida”, diz.
Essa é uma das razões, a propósito, para que os avanços em reparação e regeneração cardíaca, uma de suas grandes linhas de pesquisa, em paralelo aos estudos sobre hipertensão, dependam tanto da montagem e da compreensão desse quebra-cabeça da regeneração pós-natal, quer dizer, daquela que se faz necessária frente a uma lesão que se apresente em qualquer período da vida, desde o quarto dia após o nascimento até suas décadas mais avançadas.
Em tempo, o artigo da Scientific Reports tem como primeira autora Agatha Ribeiro da Silva, uma jovem cientista que era ainda mestranda durante a pesquisa que o originou, orientada por Krieger no Instituto do Coração (InCor) da FMUSP – hoje ela faz doutorado no Instituto Max Planck de Biomedicina Molecular, na Alemanha. Outros oito pesquisadores, três mulheres e cinco homens, são coautores, sete dos quais ligados também ao InCor e um à Escola Paulista de Medicina da Universidade Federal de São Paulo (Unifesp).
Krieger observa que, a par de sua produção irrisória, o cardiomiócito é muito especializado, o que torna “a regeneração cardíaca difícil”. Assim, quando em pacientes com lesão cardíaca injeta-se por via muscular cardiomiócitos derivados de células embrionárias ou IPS (células tronco pluripotentes induzidas, obtidas artificialmente em laboratório), elas não têm efeito positivo sobre os sítios de arritmia porque não conseguem formar uma aglomeração funcional, um sincício, em que o estímulo elétrico se propaga facilmente de uma célula para outra.
Padrão de células do sistema de condução ventricular mediadas por fibroblastos cardíacos (crédito: https://doi.org/10.1038/s41598-020-73159-0)
O efeito da proximidade
Afora o destaque da centralidade do Notch1 na maturação pós-natal de cardiomiócitos do sistema de condução ventricular, o artigo dos pesquisadores brasileiros trouxe algumas indicações novas ligadas à interação celular entre fibroblastos cardíacos e cardiomiócitos, que pode estar diretamente ligada à proximidade entre os dois grupos de células, e que facilitaria, por exemplo, a migração de proteínas de um lado para outro.
Nos termos do artigo, “novos estudos serão necessários para investigar se essa interação celular entre fibroblastos cardíacos e cardiomiócitos também ocorre in vivo; para determinar os fatores secretados que causam essa resposta; e se cardiomiofibroblastos resultarão em mudanças qualitativas ou quantitativas em tal resposta, sob condições patológicas que contribuem para aumentar eventos arritmogênicos e morbi-mortalidade associada a eles”. Por ora, já se tornou mais evidente “o possível papel dos fibroblastos cardíacos no desenvolvimento do sistema de condução ventricular” e é possível que os achados levem a novas percepções a respeito da gênese e do rumo de arritmias associadas a lesões cardíacas.
O grupo de pesquisa sobre reparação e regeneração cardíaca liderado por Krieger publicou recentemente dois outros artigos que contribuem para o adensamento da compreensão do descompasso, digamos assim, entre cicatrização de lesões do músculo cardíaco e propriedades mecânicas do coração. Ou, em outras palavras, por que a cicatrização altera as propriedades mecânicas do coração. O primeiro, sobre mudanças na expressão das vias imunológicas e do gene do movimento celular em roedores foi publicado em 23 de julho, e o segundo, sobre a importância da estimulação elétrica na maturação pós-natal dos cardiomiócitos, saiu em 27 de setembro.
No horizonte do grande conjunto de pesquisas sobre reparação e regeneração cardíaca estão, além do desvendamento do fenômeno, claro, as esperanças de novas estratégias para tratar as arritmias pós-lesão, o que faz vislumbrar à distância inibidores dos genes envolvidos no surgimentos dos sítios de arritmia ou drogas antagonistas do receptor dos genes implicados etc. É bom lembrar que células tronco e reparação celular valeram o Nobel de Medicina de 2012 para o japonês Shinya Yamanaka e o inglês John Gurdon. Separados por 44 anos de distância, eles descobriram que células adultas podem ser reprogramadas para se especializar em variados tecidos corporais, como os dos nervos, ossos, pele e músculos – mas não o do coração.